CAR-T细胞制备推荐操作方法
Day 0:T细胞复苏与激活
复苏1-2×10⁷T细胞,接种于100mm培养皿(8 mL培养基/皿,可添加Benzonase核酸酶降解游离DNA);
洗涤3×10⁷CD3/CD28磁珠(2%HSA的DPBS洗涤2次),加入复苏的T细胞中进行激活。
Day 2:慢病毒转导
离心收集细胞(300g, 5min),重悬至1-2×10⁶ cells/mL;
加入CAR慢病毒,MOI=20(可辅加终浓度为8μg/mL的Polybrene 提高转染效率),六孔板离心转染(1000g, 2 h)。
Day 3:细胞培养及扩增
离心收集细胞(300g, 5 min),重悬调整密度至1×10⁶ cells/mL,继续培养48小时。
Day 5:细胞培养及扩增
细胞计数并取 1×10⁶ CAR - T细胞流式检测转导效率(Protein L-FITC染色),其余细胞补液继续培养(调节细胞密度至5-10×10⁵ cells/mL)。
Day 6:细胞培养及扩增
细胞计数,并调节细胞密度至5-10×10⁵ cells/mL。培养体积50毫升,可转移入INNOVESSEL™ 进行扩增培养。
Day 7:细胞培养及扩增
细胞计数,补充培养基使细胞密度维持在5 - 10×10⁵ cells/mL,继续培养细胞。
Day 8 - Day 10:细胞培养及扩增
重复细胞计数及补液操作。若细胞培养基体积超过180 - 200毫升,可在细胞密度小于2×10⁶ cells/mL时每两天进行一次完全换液,以后需每天进行完全换液直至细胞收获(具体收获时间请按照用户自己计划进行)。
我们按此操作方式,用来自三个Donor的T细胞进行了两次CAR - T制备实验:
细胞转导效率在30%至40%之间;
CAR - T 细胞在lINNOVESSEL™培养瓶中扩增迅速并可进行高密度培养。
lINNOVESSEL™培养瓶中扩增的CAR - T细胞体外药效同传统培养瓶相同。
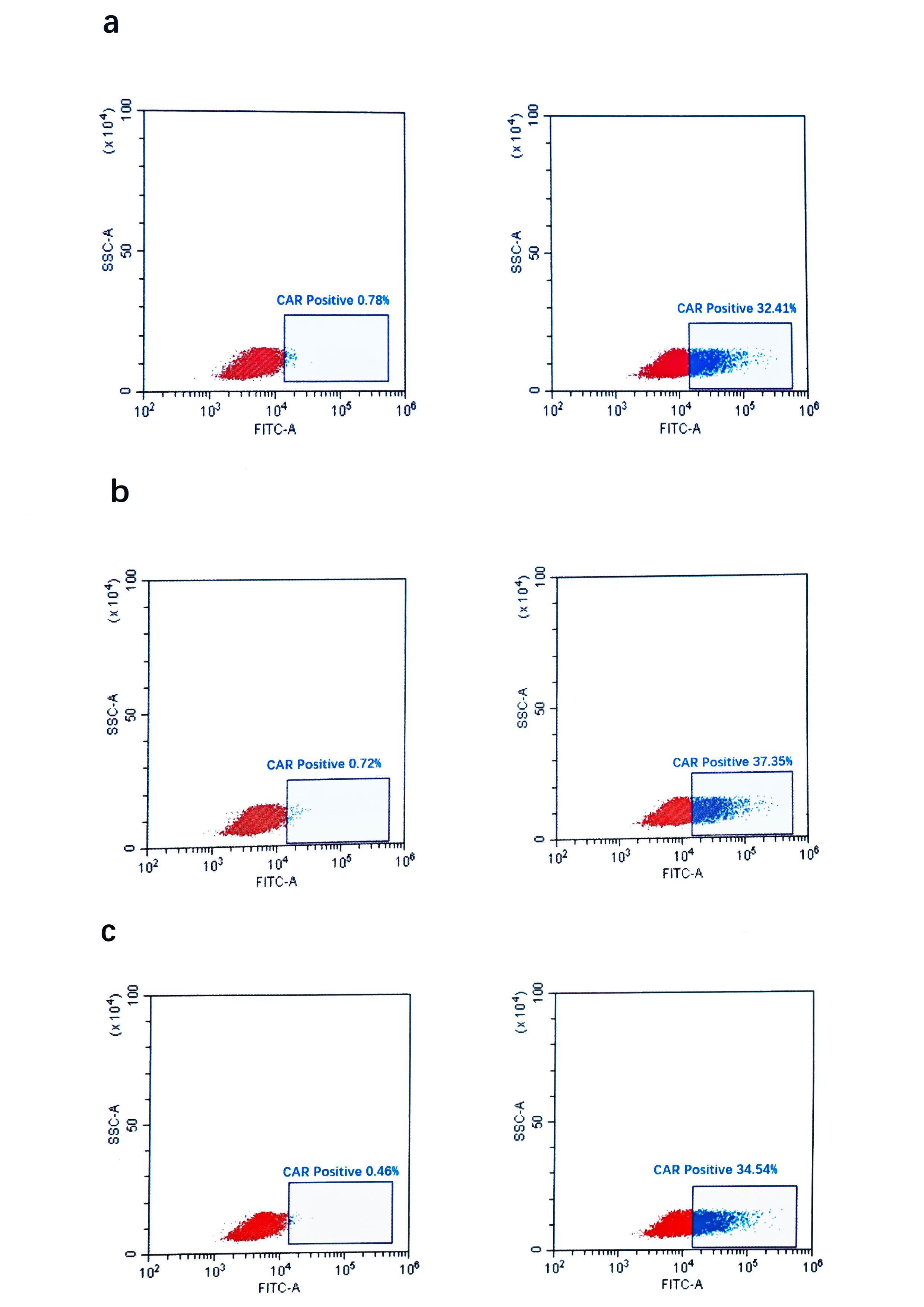
图 2:不同 Donor 来源的 CD19 CAR - T 细胞转导效率
三个不同 Donor(1/2/3)来源的T细胞经48小时激活后,以MOI=20转导CD19CAR慢病毒转导制备CAR-T细胞。转导后48小时用Protein L标记CAR分子后流式细胞仪检测转导效率。转导效率如图所示(图2a、2b、2c分别对应Donor-1、Donor-2、Donor-3)。
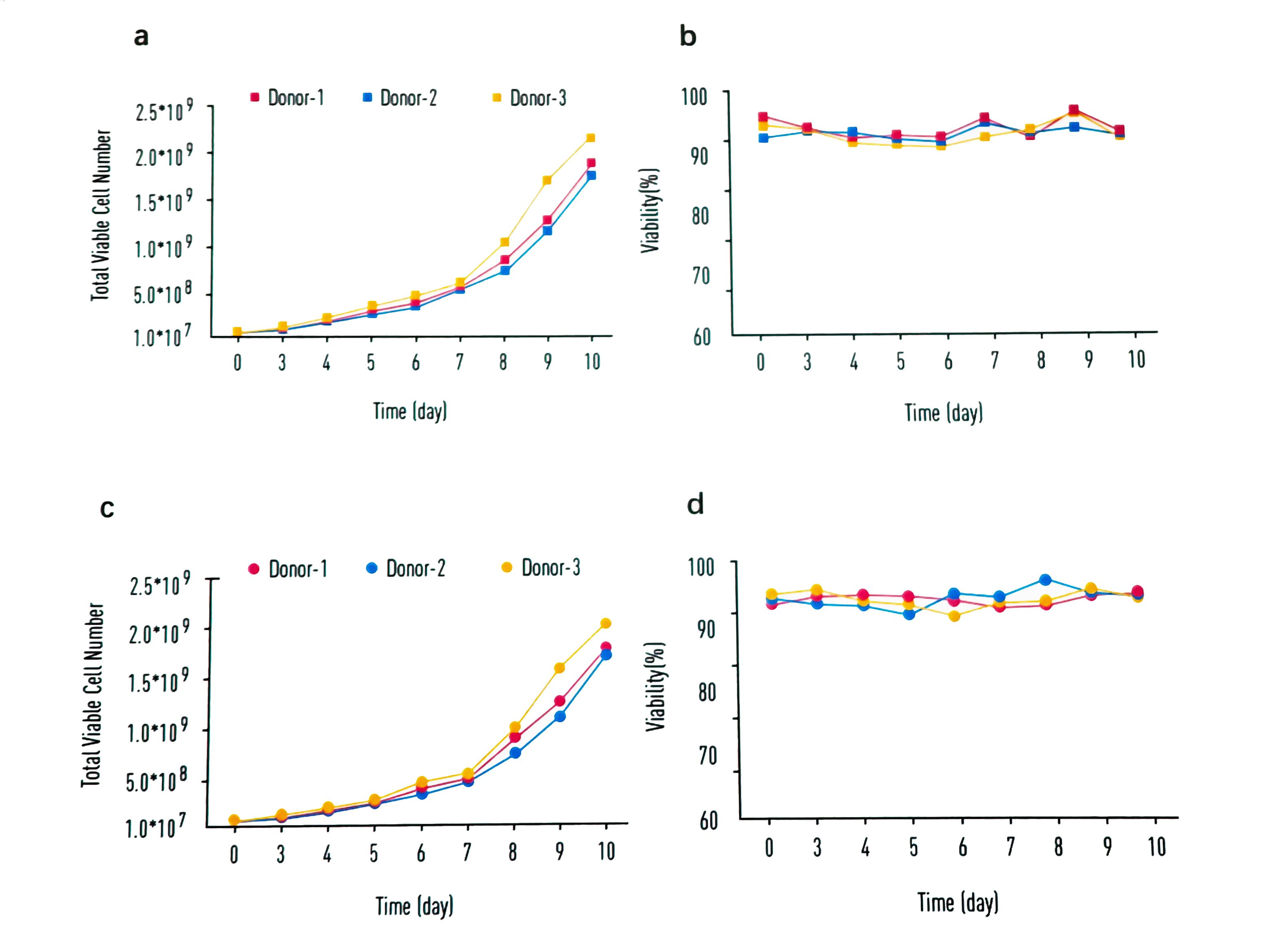
图3:INNOVESSEL™中CAR - T细胞的扩增
由三个不同Donor来源的T细胞所制备的CAR - T细胞在INNOVESSEL™中扩增良好,总细胞数目及细胞活率检测结果如图所示:细胞数目可在10天内扩增至起始数目200倍左右并且始终维持高活率。
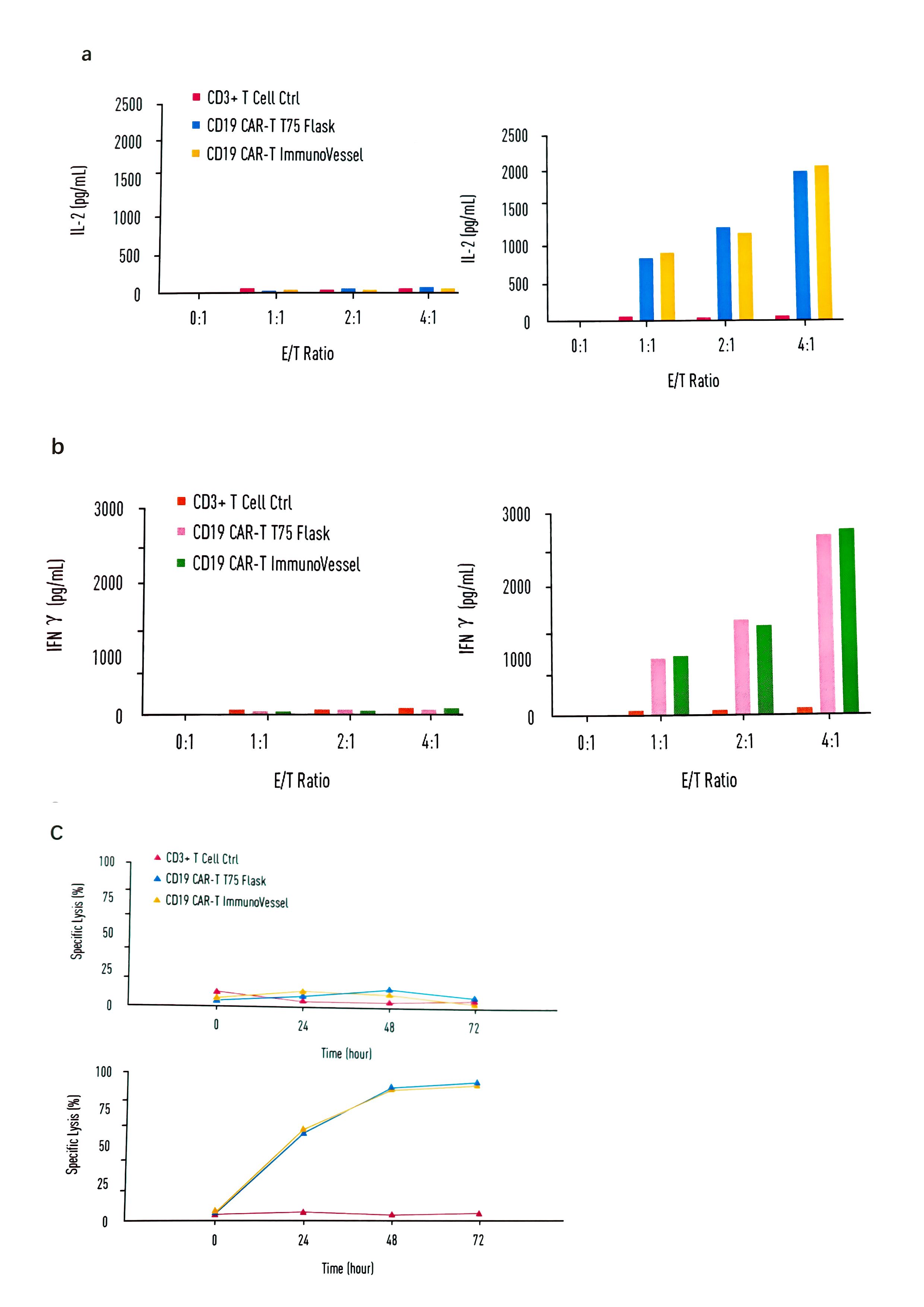
图4:用INNOVESSEL™ 和传统Flask培养瓶分别扩增出的CAR - T细胞体外药效相同
CD19 CAR-T细胞经INNOVESSEL™和传统T75 Flask 培养瓶扩增后,同时取样检测细胞因子释放及体外杀伤效果。实验所用CD19阴性细胞系为Jurkat细胞,阳性细胞系是Raji细胞。INNOVESSEL™培养瓶中扩增的CAR-T细胞显示正常的体外药效。
在标准的10天制备过程中,CAR-T细胞可扩增约200倍,且收获时细胞仍处于对数生长期,活率持续维持在>90%。
INNOVESSEL™培养瓶的高透气性设计使其能够支持超高密度培养(接近1×10⁷ cells/mL)。以1×10⁷ 个起始T细胞 在200mL培养体积 中扩增为例,单个INNOVESSEL™可收获总细胞数约2×10⁹。
CAR阳性细胞产量估算:
转导效率:30%-40%
单个培养瓶CAR+细胞产量:6-8×10⁸
注:本文件仅供参考,请针对自己的特定应用进行优化
您在使用INNOVESSEL™ 培养瓶过程中,如有任何建议和意见均可联系我们,您可以通过网站或者微信同我们取得联系


